
¿Por qué es importante el Flúor para los dientes?
mayo 24, 2017 10:14 am Deja tus comentariosEl flúor es un oligoelemento para los mamíferos en su forma de fluoruro de sodio. Podemos encontrarlo en el agua y en las pastas dentífricas, ayudando a que nuestros dientes se mantengan sanos y sin caries.

¿Cómo actúa este componente?
El flúor es un elemento que se halla en tierra, aire y mar, siendo el halógeno más cuantioso en la corteza terrestre. Su condición de oligoelemento es debida a que necesita el cuerpo para funcionar de forma correcta. En el siglo XX, los científicos investigaron que los niños que consumían flúor en el agua, poseían una mayor inmunidad ante la caries. En la década de los 40, en algunas comunidades comenzó la costumbre de agregar flúor al agua para evitar debilidad en los dientes.

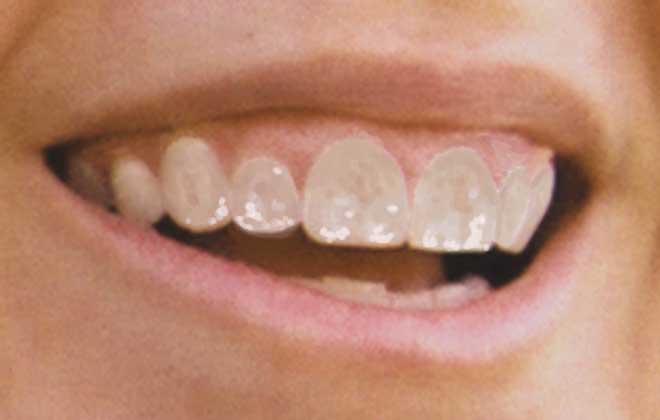
El flúor ayuda a los dientes porque cuando están creciendo, se mezcla con el esmalte exterior protector de los mismos y lo refuerza. De esta forma, se evita la caries e incluso el flúor sigue ayudando cuando los dientes ya están formados.
El flúor también trabaja en conjunto con la saliva para proteger el esmalte de los dientes frente al sarro y los azúcares. Por eso, al usar dentífricos fluorados, ayudamos a los dientes en la prevención de la caries.
La falta de flúor en nuestra dieta y aguas que consumimos, se puede evitar realizando enjuagues con colutorios bucales o incluso con la ayuda de complementos alimenticios que contengan flúor.


Sobre los inconvenientes del flúor, podéis leer algo más aquí y aquí en una forma algo sensacionalista.
Características del Flúor
El flúor es un gas a temperatura ambiental, de un color amarillento pálido, constituido por moléculas diatómicas F2. Es el elemento más electronegativo y reactivo de todos. En su forma pura es muy peligroso, ya que causa fuertes quemaduras químicas si entra en contacto con la piel, debido a que es corrosivo y muy oxidante.
Aun cuando se halla privado de luz y a temperaturas bajas, el flúor responde de manera explosiva ante el hidrógeno. Bajo un chorro de flúor en estado gaseoso, el vidrio, metales, agua y otras sustancias, se queman en una llama resplandeciente. En la naturaleza, siempre se halla combinado y posee gran similitud con otros elementos, como el silicio, que no se puede conservar en envases de vidrio.
Disuelto en un medio acuoso, el flúor se muestra generalmente en forma de ion fluoruro, F-. Otras variantes serían fluorocomplejos como el [FeF4]-, o el H2F+.
Los fluoruros son composiciones en las que el ion fluoruro se conjunta con algún resto cargado de manera positiva.
La palabra flúor proviene del latín fluere, que significa “fluir”. El fluor, que forma parte del mineral fluorita, CaF2, fue expuesto por primera vez por Georgius Agricola en 1529 en su uso como fundente, usado para lograr la unión de metales o minerales. En 1670, Schwandhard investigó que si el vidrio se exponía a la fluorita sometida con ácido, se podía grabar en él.
Carl Wilhelm Scheele y varios científicos posteriores, como Antoine Lavoisier, Humphry Davy, Louis Joseph Gay-Lussac o Louis Jacques Thénard, hicieron pruebas con el ácido fluorhídrico, acabando muchos de ellos en grandes desastres.
Se tardó mucho tiempo en separarlo, ya que siempre reaccionaba con otros elementos en cuanto se aislaba alguno de sus compuestos. Finalmente, el químico francés Henri Moissan logró separarlo en 1886.
La primera producción comercial de flúor se destinó a la bomba atómica del Proyecto Manhattan, para lograr hexafluoruro de uranio, UF6, utilizado en la división de isótopos de uranio. Dicho proceso se ha seguido usando para aplicaciones de energía nuclear.

Cristales de fluorita
Visto en: Blog Odisea
Categorizado en: NOTICIAS
Esta entrada fue escrita porSonrisas Por Colombia
